عملکرد کلی باتری
مقدمه:
همانطور که میدانیم، باتری ابزاری برای ذخیره انرژی است که از زمانهای قدیم، بشر به دنبال بهبود عملکرد آن بوده و تا به امروز نیز پیشرفتهای شگرفی را در این زمینه مشاهده کردیدهایم. بدون باتری، تقریبا نمیتوان در جامعهی امروزی زندگی کرد و وسایلی از جمله موبایل و لپتاپ، بدون باتری تقریبا بیمعنی میشوند.
باتری از سال 1800 تا به امروز، مراحل گوناگونی را سپری کرده و اولین بار که پروفسور ولتا، استاد فسفهی طبیعی دانشگاه پاویا در ایتالیا اولین توصیف باتری الکتروشیمیایی را ارائه داد، تا به الآن که سعی بر بهبود باتری ماشینهای الکتریکی است، شاهد پیشرفت زیادی در این زمینه هستیم. در این مقاله سعی داریم که نحوه عملکرد کلی باتریها را بیان کنیم و ببینیم که یک باتری از چه اجزایی درست شده است و چگونه کار میکند.
باتری چیست؟
همانطور که در مقدمه اشاره شد، باتری یک وسیله جهت ذخیرهی انرژی است که میتواند در کاربردهایی که نیاز است وسایل الکتریکی و الکترونیکی بدون اتصال به برق کار کنند، به کار روند. انتقال انرژی به مدار میتواند از طریق حرکت الکترونها درون مدار الکتریکی صورت گیرد و اگر بتوانیم الکترونها را مجبور به حرکت درون مدار کنیم، توانستهایم انرژی را به مدار انتقال دهیم. اساس کار باتری به این صورت است که الکترون به صورت خود به خودی، از سمتی به سمت دیگر حرکت میکند و اگر مدار الکتریکی جلوی راه آن باشد، این الکترون از داخل آن عبور کرده و باعث انتقال انرژی به مدار میشود. شکل زیر انتقال الکترون به مدار توسط باتری در فرایند دشارژ را نشان میدهد.
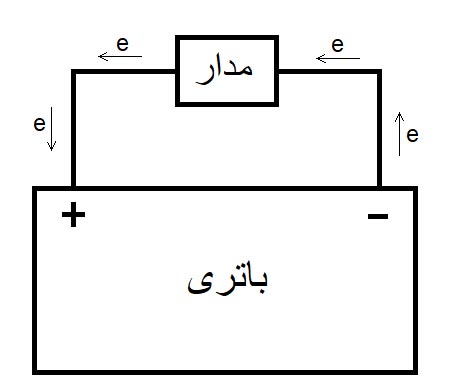
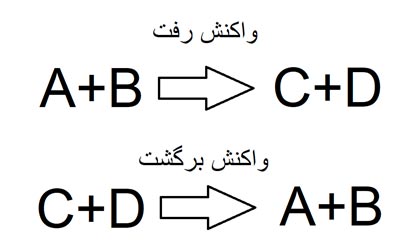
در باتری، ساز و کار انتقال الکترون، به صورت واکنشهای شیمیایی است که با انجام واکنش، الکترون از سمتی به سمت دیگر حرکت میکند و با تغییر این واکنشها، نوع باتری تغییر میکند که حتی میتوان با کمک واکنشهای برگشتپذیر، یک باتری قابل شارژ ساخت که چندین سال برای ما کار کند و نیاز به تعویض آن نباشد درحالی که اگر از موادی استفاده کنیم که واکنش انتقال الکترون آنها برگشت پذیر نباشد، باتری ساخته شده یک باتری غیر قابل شارژ خواهد بود و نیاز به تعویض آن است. برگشتپذیر بودن یک واکنش به این معناست که واکنش انجام شده در جهت عکس نیز قابل انجام باشد. شکل زیر واکنش رفت و برگشت را نشان میدهد.
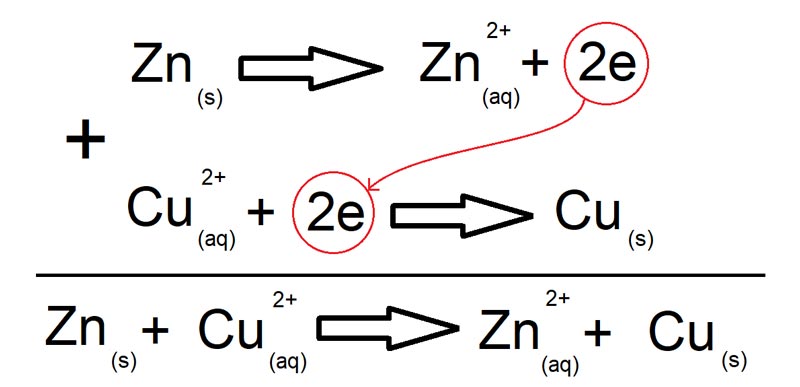
در یک باتری، واکنش کلی، خود به دو نیم واکنش تقسیم میشود که هر کدام از این واکنشها در دو سمت مختلف باتری انجام میشود. به عنوان مثال دو نیم واکنش زیر را در نظر بگیرید. در این دو نیم واکش، الکترون در یک سمت از ماده خارج شده و در سمت دیگر وارد مادهی دیگر میشود که در اینجا عنصر جامد روی(Zn) با دادن الکترون، به صورت محلول در آب تغییر شکل داده و درسمت دیگر باتری، یون مس با گرفتن این الکترون، از حالت محلول در آب، به حالت جامد در میآید.
با جمع کردن این دو نیم واکنش، واکنش کلی این سلول الکتروشیمیایی به دست میآید. این سلول الکتروشیمیایی به سلول دانیل معروف است که توسط شیمیدان بریتانیایی جان فردریک دانیل معرفی شد و در این سلول، با رخ دادن این دو نیم واکنش، انتقال الکترون از سمتی به سمت دیگر انجام میشود. در این سلول، الکترونها، تمایل بیشتری دارند که به سمت ناحیهی مس حرکت کنند به عبارت ساده تر، الکترونها، مس را بیشتر از روی دوست دارند و از سمت ناحیهی روی، به سمت ناحیهی مس میروند.
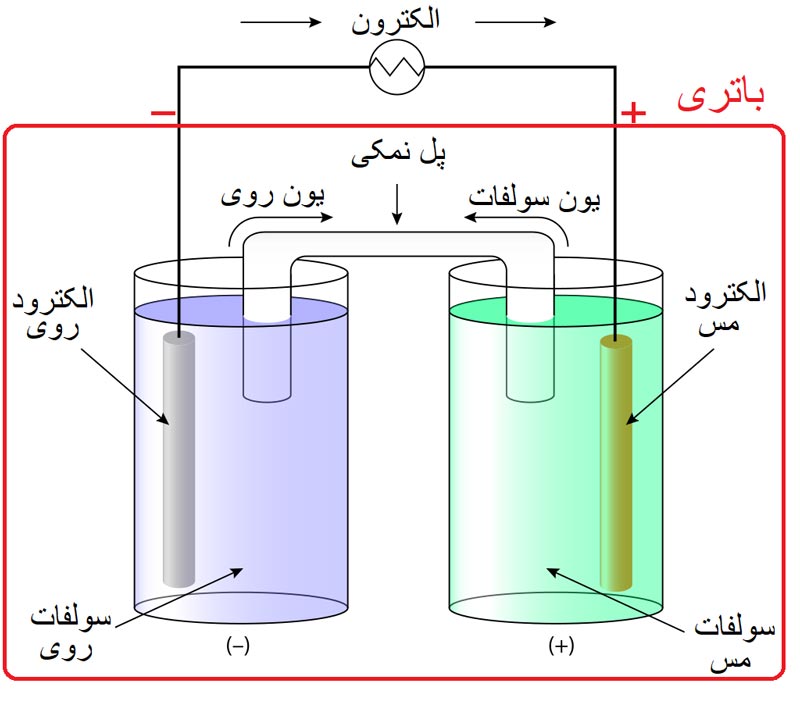
مطابق شکل 4، روی با تحویل الکترون خود به مدار، به صورت حل شده وارد محلول میشود و سپس الکترون خارج شده از روی، به سمت محلول مس دار حرکت میکند و یون مس حل شده، این الکترون را دریافت کرده و به فلز مس تبدیل میشود. لازم به ذکر است که انتقال یون های مثبت و منفی درون الکترولیتها نیز اتفاق میافتد و با مبادلهی یونها، پایداری بار در دو ناحیه حفظ میشود. در این سلول، پل نمکی نقش انتقال این یونها را از سمتی به سمت دیگر دارد و این پل نمکی، از جنس یک نمک مانند KCl است.
تاکید این نکته خالی از لطف نیست که واکنشها به صورت خود به خودی انجام میگیرد و همانطور که اشاره شد، الکترون دوست دارد که بیشتر به سمت فلز مس برود تا این که در سمت فلز روی باشد. سلول دانیل مثال بسیار سادهای از عملکرد یک باتری است و میتوان ادعا کرد که اساس باتری، بر پایهی این سلول است. شکل زیر دو نیم واکنش سلول دانیل به همراه واکنش کلی را نشان میدهد.
همچنین شکل زیر شمای کلی سلول دانیل. اساس یک باتری بر پایهی این سلول است.
اجزای باتری
در قسمت قبل دیدیم که اساس یک باتری، بر پایهی سلول دانیل است و با رخ دادن واکنش های شیمیایی، انتقال الکترون از سمتی به سمت دیگر اتفاق می افتد. حال که عملکرد کلی باتری را فهمیدیم، لازم است که کمی بیشتر با ساختار درون باتری آشنا شویم.
یک باتری از سه جز اصلی الکترود مثبت، الکترود منفی و الکترولیت تشکیل میشود که در هنگام دشارژ باتری، الکترود منفی، نقش دهندگی الکترون را بازی میکند و الکترود مثبت، نقش پذیرندهی الکترون را بر عهده دارد و الکترولیت، محل جا به جایی یونها درون باتری است و بدون الکترولیت، جریان درون باتری(حرکت یونها) از بین میرود و واکنشهای شیمیایی اتفاق نمیافتد چرا که این واکنشها بر مبنای انتقال یونها به سمت دو الکترود است و بدون رفتن یونها به سمت الکترودها، تبادل الکترونی صورت نمیگیرد.
در شکل زیر به صورت واضح مشاهده میکنیم که درون یک باتری چه خبر است و این شکل، این سه جزء اصلی باتری یعنی، الکترود مثبت، الکترود منفی و الکترولیت را نشان میدهد. شکل زیر شمای داخلی یک باتری به صورت کلی در فرایند دشارژ را نشان میدهد.
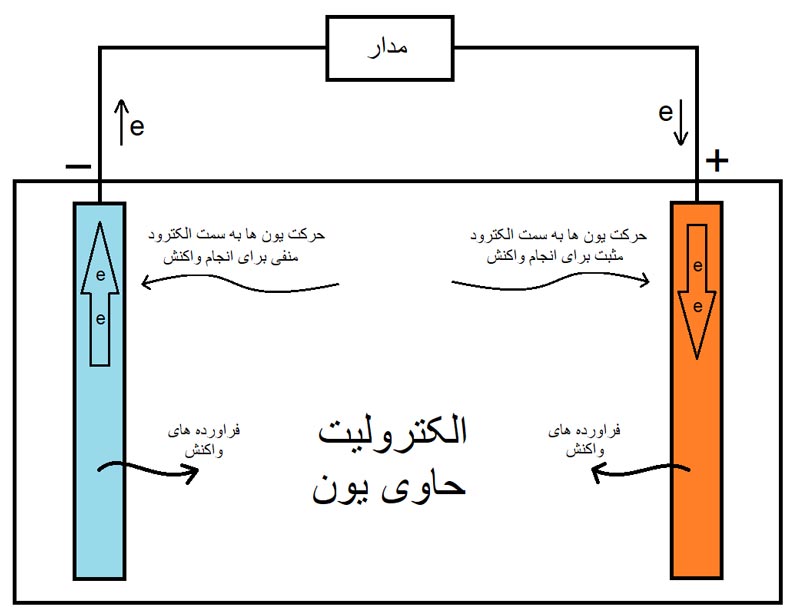
در شکل بالا ، درون یک باتری را مشاهده میکنیم و دو الکترود ومایع الکترولیت نیز قابل مشاهدهاند. در باتریها، الکترودها با واکنش دادن، الکترونها را با یکدیگر مبادله میکنند و همانطور که از شکل پیداست، فراوردههایی نیز تولید میشود که این فراوردهها یا به صورت حل شده وارد محلول میشوند و یا به شکل جامد، بر روی الکترود مینشینند ویا حتی فراورده میتواند گازی شکل باشد که در این صورت، یک راه خروجی برای خارج شدن گازها باید تعبیه کرد تا مانع از ترکیدن محفظه باتری شویم.
در بعضی از باتریها، انتقال یون ممکن است سادهتر باشد به این صورت که اتم در سمت الکترود منفی، با از دست دادن الکترون خود و تحویل آن به مدار، از طریق الکترولیت به سمت الکترود مثبت حرکت کند و در آنجا الکترون تحویل داده شده به مدار، به اتم اولیه برمیگردد که باتریهای قابل شارژ لیتیوم یون، از این قبیل دستهها میباشند که در مقالههای آتی بیشتر به آن اشاره میشود اما برای فهم بهتر باتری، شکل 6، یک باتری لیتیوم یون را نشان میدهد که اتمهای لیتیوم با دادن الکترون، به یون لیتیوم تبدیل شده و از طریق الکترولیت، به سمت الکترود مثبت حرکت کرده و در آنجا با گرفتن الکترون اولیه، به حالت نخست خود برمیگردند.
البته باید این را گفت که الکترود باتریهای لیتیوم یون، مکانیزمهای پیچیدهتری نیز دارند که در مقالهی مخصوص باتریهای لیتیوم یون، به آن میپردازیم. شکل زیر نمای داخلی یک باتری لیتیوم یون به صورت کاملا ساده در هنگام دشارژ را نشان میدهد.
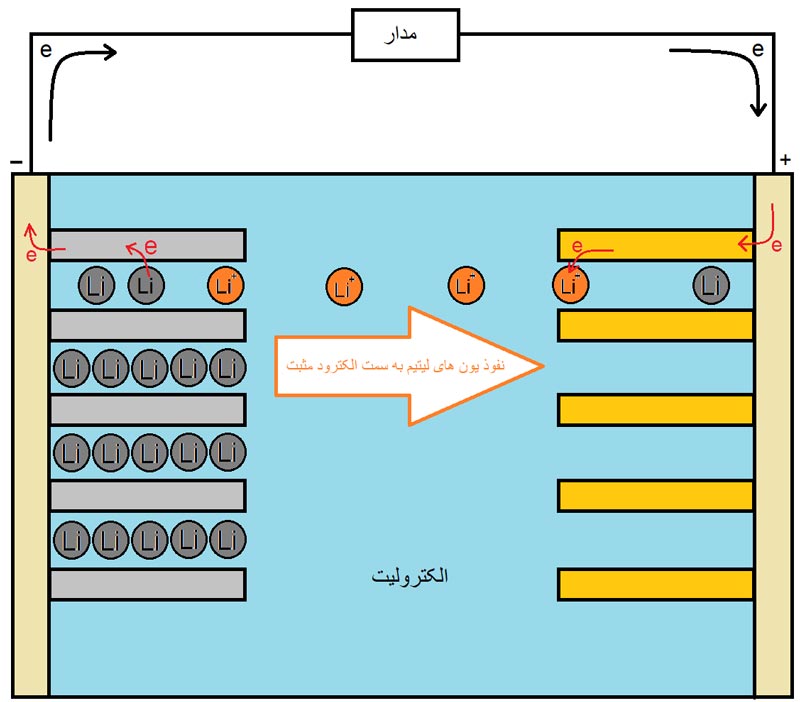
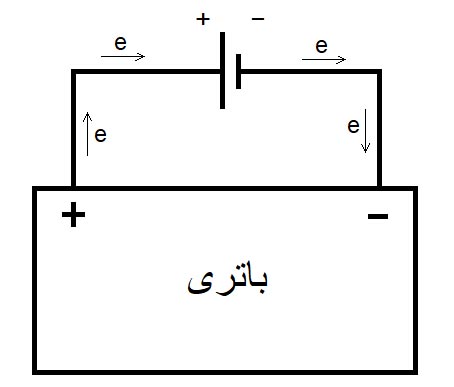
تا به اینجا ما فقط مکانیزم دشارژ باتری را بررسی کردیم. فرایند شارژ دقیقا برعکس فرایند دشارژ اتفاق میافتد به این صورت که به کمک یک منبع تغذیه، الکترونهای سمت الکترود مثبت را که در هنگام دشارژ به آن سمت رفته بودند، به سمت الکترود منفی میکشانیم و در این حالت، با اعمال ولتاژ، واکنشهای هر سمت را معکوس کردهایم.
به عبارت ساده تر، ولتاژ نقش یک نیرو را بازی میکند و الکترونهایی را که دوست دارند در سمت الکترود مثبت باشند، به سمت الکترود منفی میکشاند. پس در هنگام شارژ باتری، تمام واکنشها برعکس رخ داده و تفاوتی در فهم موضوع نمیکند اما برای مقایسهی فرایند شارژ و دشارژ، شکل 8، به خوبی این دو فرایند را نشان میدهد. شکل زیر شارژ باتری به کمک نیروی محرکهی خارجی را نشان میدهد.
شکل زیر مقایسه دو فرایند شارژ و دشارژ برای یک باتری لیتیوم یون را نشان میدهد.
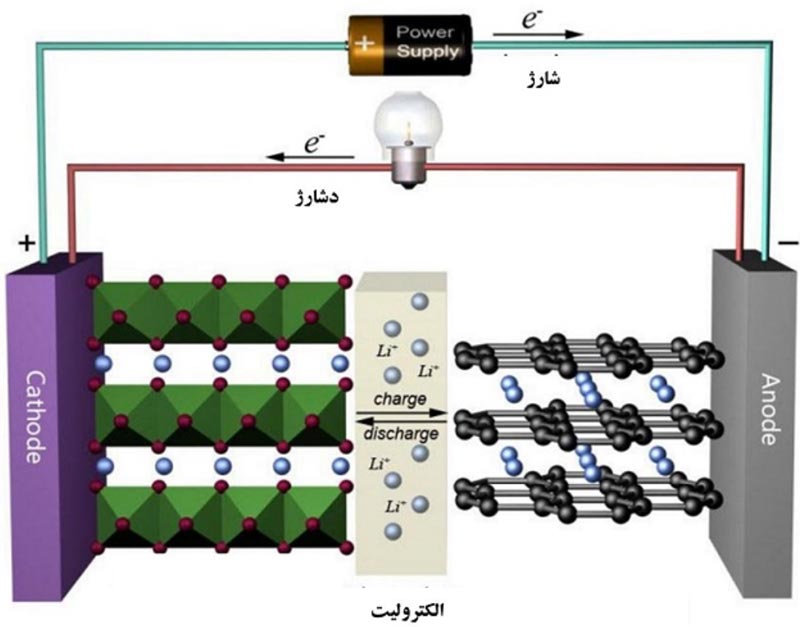
آند و کاتد چه هستند؟
تا اینجا به عملکرد کلی باتری پرداختیم ودیدیم که یک باتری بر اساس واکنشهای الکتروشیمیایی رفتار میکند و در حقیقت به زبان بسیار ساده، کلیات باتری را با یکدیگر بررسی کردیم. همانطور که اشاره شد، یک باتری بر پایهی واکنشهای الکتروشیمیایی عمل میکند و برای بیان این واکنشها، ناگزیریم از اصطلاحات شیمی به کار رفته در این زمینه استفاده کرد. پس در این قسمت به بررسی علمیتر باتری میپردازیم تا بتوانیم در مقالات بعدی، دچار مشکل نشویم.
به بیان دقیقتر، در باتری، دو واکنش اکسایش و کاهش رخ میدهد که این دو واکنش، مبنای انتقال الکترون هستند.در واکنش اکسایش، واکنشدهندهها الکترون آزاد میکنند ولی در واکنش کاهش، واکنشگرها الکترون میگیرند. در فرایندهای الکتروشیمیایی، آند، الکترودی است که در آن واکنش اکسایش صورت گیرد و کاتد الکترودی است که بر خلاف آند، واکنش کاهش در آن رخ دهد. پس در باتری،آند الکترودی شد که الکترون میدهد و کاتد الکترودیست که الکترون میگیرد.
با این تعاریف، در هنگام دشارژ، الکترود مثبت و منفی، به ترتیب کاتد و آند هستند و در هنگام شارژ، آند و کاتد جای خود را عوض میکنند زیرا فرایند گرفتن و دادن الکترون، برعکس میشود. نکتهی مهمی که در اینجا پیش میآید این است که قطب منفی و مثبت همیشه ثابت هستند و با معکوس شدن فرایند انتقال الکترون، این دو قطب جا به جا نمیشوند زیرا قطب مثبت و منفی، به جنس ماده مربوط است که اطلاعات دقیقتر آن، در مقالههای آتی آورده میشود. اما برای راحتی، به صورت قرارداد، آند و کاتد را برای همیشه، برای فراید دشارژ تعریف میکنیم و در فرایند شارژ، آند و کاتد تغییر نمیکند پس چه در فرایند شارژ و چه در فرایند دشارژ، آند الکترود منفی است و کاتد اکترود مثبت خواهد بود.
خلاصه و نتیجهگیری
در این مقاله کلیات باتری را مطرح کردیم و دیدیم که پایه و اساس یک باتری، واکنشهای الکتروشیمیایی است که با اتفاق افتادن این واکنشها، الکترون از سمتی به سمت دیگر منتقل میشود و با انتقال این الکترونها، انرژی به مدار تحویل داده خواهد شد. همچنین دیدیم که این واکنشها به صورت خود به خودی اتفاق میافتد و این خود به خودی بودن واکنش، به معنای آزاد شدن انرژی است.
در ادامهی مقاله به این اشاره شد که اگر یک باتری بخواهد شارژ شود، نیاز داریم که واکنشهای رخ داده در آن برگشت پذیر باشد و در این صورت، با اعمال یک نیروی اضافه، میتوان الکترونها را به جای اول باز گرداند و این نیروی اضافی، به صورت انرژی در باتری ذخیره میشود(درست مانند رها کردن یک سنگ از بالای کوه و سپس بالا آوردن آن به کمک یک نیروی خارجی). در نهایت کمی با ادبیات رشتهی شیمی آشنا شدیم و دیدیم که آند و کاتد، به صورت قرار دادی همان الکترد منفی و مثبت (به ترتیب) هستند و از این به بعد الکترودها را با این نام خواهیم شناخت. در مقالههای بعد به جنبههای دیگر باتری میپردازیم و خواهیم دید که خصوصیات یک باتری، مانند ولتاژ، جریان و ظرفیت، به چه پارامترهایی ارتباط دارد.




با سلام و خسته نباشید خدمت دست اندرکاران محترم وب سایت موفق رها باتری
واقعا مطالبتون عالیه – خیلی مطالب رو ساده و روان بیان کردید.
خدا خیرتون بده
سلام خدمت شما آقای نوری. از اظهار لطفتون ممنونیم