بررسی مقالات باتری لیتیوم سولفور(قسمت چهارم)
جداکننده (separator):
در این قسمت به اهمیت جداکننده ها در باتری های لیتیوم سولفور می پردازیم و خواهیم دید که یک جداکننده، چگونه کارایی یک باتری را افزایش می دهد. در این قسمت ما فقط یک مثال را بررسی میکنیم و در نهایت با مقایسه ی نتایج عملی، شاهد پیشرفت چشمگیر این باتری ها خواهیم بود.
جداکننده یک لایه ی نازک است که بین آند و کاتد قرار میگیرد و از اتصال دو الکترود ممانعت به عمل می آورد. این لایه خصوصیات مهمی را باید داشته باشد که از جمله ی این ویژگی ها، هدایت یونی بالا برای یون لیتیوم، استحکام مکانیکی بالا، وزن کم و ضخامت اندک است. برای باتری های لیتیوم سولفور، یک ویژگی مهم دیگر باید وجود داشته باشد و آن این است که به پلی سولفیدها اجازه ی عبور ندهد که به این ترتیب از نفوذ این پلی سولفیدها به سمت آند، ممانعت به عمل می آید. درمقالهای که در سال 2016 چاپ شد، محققان با معرفی یک جداکننده ی بسیار خوب، نتایجی بسیار مناسبی را به دست آوردند که بسیار امید بخش برای این نوع از باتری هاست.
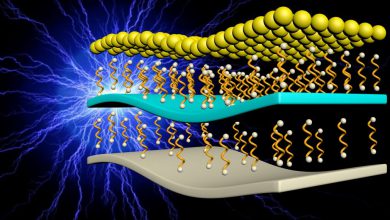
در این مقاله، محققان یک جداکننده ی سه لایه را معرفی کردند که این جداکننده، از نفوذ پلی سولفیدها جلوگیری میکند. مطابق شکل 18، این سه لایه به ترتیب پلی پروپیلن (polypropylene که به اختصار PP نانیده میشود)، گرافن اکساید(GO)، و لایه ی Nafion است که هر کدام وظایف مخصوص به خود را دارند.

از این شکل، میتوان فهمید که پلی سولفیدها، به دلیل بار منفی خود، توانایی عبور از لایه ی جداکننده را ندارند و دلیل آن هم این است که لایه ی Nafion، به دلیل بار منفی خود، به کمک نیروی دافعه ی الکترونی، پلی-سولفیدها را از خود دور نگه میدارد. این لایه برای عبور کاتیون ها بسیار مناسب است و در نتیجه گزینه ی بسیار خوبی برای عبور یون لیتیوم است پس میتوان از این لایه به عنوان یک جداکننده در باتری های لیتیوم سولفور لستفاده کنیم. شکل 19، ساختار شیمیایی این ترکیب را نشان میدهد.

لایه ی PP، نقش اسکلت خارجی این جداکننده را بازی میکند و به عبارت دقیق تر، شاکله ی اصلی جداکننده را تشکیل میدهد. این لایه، در حقیقت، استحکام مکانیکی را بالا برده و با تغییرات فشار، حالت خود را حفظ میکند و با از بین رفتن فشار مکانیکی، به حالت اولیه ی خود باز میگردد. این پلیمر، یک پلیمر ارزان قیمت است و از پر مصرف ترین پلیمرهای موجود در بازار میباشد.
 شکل 20 ساختار شیمیایی PP
شکل 20 ساختار شیمیایی PP
لایه ی گرافن اکساید، یک لایه ی میانی برای دو لایه ی PP و Nafion است و باعث میشود که لایه ی Nafion، به درون تخلخل های PP نفوذ نکند و همچنین، مقدار Nafion مورد استفاده کمتر میشود. گرافن اکساید در این آزمایش، حدود 40 لایه است و ضخامت تقریبی 30nm را دارد و ضخامت لایه ی Nafion که بر روی GO قرار میگیرد، در حدود 100nm است که ضخامت کمی است. لازم به ذکر است که با اضافه شدن این دو لایه به لایه ی PP، مقاومت مکانیکی تغییری نمیکند و همچنان، قادر به تحمل فشارهای مختلف است.
شکل 21، نمای نزدیک از سه جداکنندهی مختلف را نشان میدهد که در سه حالت مختلف، با یکدیگر مقایسه شدهاند. ملاحظه میشود که با اضافه شدن لایه ی گرافن اکساید، رنگ جداکننده، تیره تر شده و زمانی که لایه ی Nafion اضافه میشود، تقریبا شفافیت آن از بین میرود. شکل 22 نیز، تصاویر میکروسکپی از سه مرحله ی ساخت جداکننده نشان میدهد و ملاحظه میکنیم که با اضافه شدن لایه ها، چه تغییری در ساختار جداکننده ایجاد شده است.


در شکل 23، میتوان دید که چگونه این جداکننده، مانع از پخش شدن پلی سولفیدها شده است که بعد از گذشت 16 ساعت، رنگ محلول در حالت PP/GO/Nafion تغییری نکرده و تاثیر این لایه به وضوح مشخص است. در انتها، به مقایسه ی بین دو حالت جداکننده ی معمولی، و جداکننده ی طراحی شده، میپردازیم. شکل 24، این مقایسه را انجام میدهد. در این شکل، ملاحظه میکنیم که چگونه با یک ایده ی ساده، بهبود عملکرد را نتیجه میگیریم. ترکیب این روش با روشهای دیگر، نتایج شگفت انگیزی را برای ما دارد و حتی این ایده ی ساده، در صنعت نیز قابل اجرا است.


الکترولیت:
یکی از اجزای مهم باتری، الکترولیت است که نقش آن، تبادل یون بین دو الکترود آند و کاتد میباشد. الکترولیت نقش بسیار مهمی را در باتریها دارد و با طراحی درست و دقیق، بسیاری از مشکلات میتواند حل شود. یکی از مهمترین موضوعات مورد بررسی در طراحی الکترولیت، تشکیل لایهی جامد بین الکترود آند و الکترولیت است که به SEI معروف است. این لایه خصوصیات بسیار مهمی را باید داشته باشد که از جملهی این خصوصیات، پایداری عالی، هدایت یونی بسیار خوب، ضخامت مناسب و ساختار فشرده است که در هنگام طراحی الکترولیت، به این موضوعات، توجه ویژهای میشود.
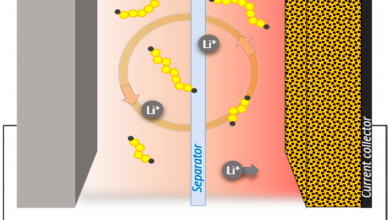
در باتریهای لیتیوم سولفور نیز، الکترولیت اهمیت ویژهای دارد زیرا در این باتریها، بر خلاف دیگر باتریهای لیتیوم یون معمولی، علاوه بر اجزای الکترولیت، پلیسولفید نیز درون الکترولیت وجود دارد. این پلی سولفیدها با رسیدن به سمت آند، به Li2S/Li2S2 تبدیل میشوند و سطح لیتیوم را غیرفعال میکنند و مانع از انتقال یون لیتیوم میشوند. پس همانطور که متوجه شدیم، این باتریها، مشکل جدیدی دارند که باید با طراحی درست الکترولیت، آن را برطرف نمود. در سال 2009، آقای Aurbach با اضافه کردن لیتیوم نیترات (LiNO3) به الکترولیت، موج جدیدی از تحقیقات در این زمینه را آغاز کرد.
لیتیوم نیترات، با تبدیل پلیسولفید به یک لایهی محافظ از جنس LixSOy/LixNOy، از پدیدهی شاتل جلوگیری میکند و عملکرد باتری را به طور چشمگیری بهبود میبخشد. شکل 25، لایههای تشکیل شده در حضور LiNO3/DOL/PS/LiTFSI است که در این شکل، لایههای تشکیل شده در حضور هر یک از این مواد را نشان میدهد. نکتهی مهم در اینجا این است که اگر پلیسولفید در الکترولیت وجود نداشته باشد، این لایهها ایجاد نمیشوند و حتی ممکن است که تاثیر منفی بر روی آند نیز داشته باشند.
یکی از نکات مهم در این باتریها این است که اگر ولتاژ در سمت کاتد، از 1.6 ولت پایینتر بیاید، لیتیوم نیترات در سمت کاتد مصرف شده و دیگر قابلیت بازیابی نخواهد داشت، پس باید ولتاژ cut off در این حالت، 1.6 ولت باشد تا لیتیوم نیترات، همچنان در الکترولیت وجود داشته باشد.

نکتهی جالب دیگر در این نوع از الکترولیتها، عدم وجود دندریتهای تیز در سمت لیتیوم است، به عبارت بهتر، دندریت در این نوع از باتریها که از الکترولیتهای بر پایهی لیتیوم نیترات استفاده شده است، ساختار همواری دارد. شکل 26، به صورت گرافیکی، این حقیقت را نشان میدهد.

یکی از ایدههای بسیار خوب و قابل تحسین، ایجاد لایهی SEI به صورت مصنوعی است، یعنی ابتدا بر روی فلز لیتیوم، یک لایهی SEI دلخواهی را مینشانیم که این لایه، قرار است که نیازهای ما را بر طرف کند. در شکل 27 ، این ایده بررسی شده است. این ایده در سال 2017 توسط دانشمندان چینی مطرح شد و تقریبا میتوان گفت که یک خلاقیت بسیار عالی در زمینهی باتریهاست و میتوان از این ایده در همهی زمینهها استفاده کرد.

شکل 28، تصاویر SEM از مراحل مختلف از این ایده را نشان میدهد و تغییرات در این تصوایر، به طور محسوس، قابل دریافت است. در شکل «الف»، تصویر فلز لیتیوم را نشان میدهد که بدون لایهیSEI است و تصویر «ب»، مرحلهی بعد از لایهنشانی SEI میباشد. شکل29 نیز، عملکرد این ایده را با نمودار به تصویر میکشد و این نمودار تقریبا گویای همهی مطالب است و دیگر نیاز به توضیح بیشتر نمیباشد.


در این قسمت ما به اهمیت الکترولیت پرداختیم و دیدیم که اضافه کردن مواد ساده به الکترولیت، چه تاثیراتی را به همراه خواهد داشت. دیدیم که الکترولیت، نقش بسیار ویژهای در تشکیل SEI دارد و این SEI میتواند عملکرد باتری را تحت تاثیر قرار دهد و حتی از رشد دندریتی فلز لیتیوم جلوگیری کند.
جمع بندی:
در این مقاله روشهای مختلفی را مورد بررسی قرار دادیم و دیدیم که چگونه عملکرد یک باتری میتواند از طرق مختلف، تحت تاثیر قرار گیرد و حتی با تغییر اندک در ساختار باتری، نتایج بسیار خوبی را خواهیم گرفت. مثالهای بسیار زیادی از بهبود عملکرد این باتریها وجود دارد ولی از آوردن این مثال ها خودداری شد چون تقریبا ایدههای آنها شبیه به مثالهای بررسی شده در این مقاله بود. به هر حال، سرمایه گذاری بر روی باتریهای لیتیوم سولفور، کار عاقلانهای است و میتوان امیدوار بود که در آیندهی نزدیک، شاهد پیشرفت این باتریها باشیم.