بررسی مقالات باتری لیتیوم سولفور(قسمت دوم)
کاتد
در این بخش، به بررسی انواع کاتدهای طراحی شده برای باتریهای لیتیوم سولفور میپردازیم که در سالهای اخیر بر روی این ساختارها، کارشده است. کاملا واضح است که کاتد، نقش بسیار مهمی را در ظرفیت و پایداری این نوع از باتریها بازی میکند و با طراحی درست و خلاقانه، میتوان گام بسیار مهمی را در راستای صنعتی کردن این باتریها برداشت.
کاتدهای Core/Shell
عبارت Core/Shell به معنای این است که یک ماده توسط مادهای دیگر، پوشانده شده باشد. به عبارت دقیقتر، یک هسته، توسط یک لایه، محافظ شود. به نظر میرسد که این ساختارها بتوانند عملکرد باتریهای بر پایهی سولفور را بهبود بخشند. در ادامه به دو مورد از این ساختارها میپردازیم که مشاهده میکنیم که چگونه رفتار باتریهای سولفور را تغییر میدهند.
در نمونهی اول، آقای Jian Jiang به کمک همکاران خود، توانست یک ساختار Core/Shell با ظرفیت فوقالعاده با تعداد سیکل بینظیر را برای سولفور ایجاد کند که این مقاله نیز در ژورنال Nature comm. به چاپ رسید. در این ساختار، سولفور به همراه کربن بلک (CB) ساخته شد و سپس، با کمک یک لایهی غیرارگانیک از جنس Ni3(NO3)2(OH)4 که به صورت اختصار با نام NNH شناخته میشود، این ترکیب را پوشاند و در اینجا، لایهی NNH نقش یک لایهی محافظ را برای سولفور بازی میکند.
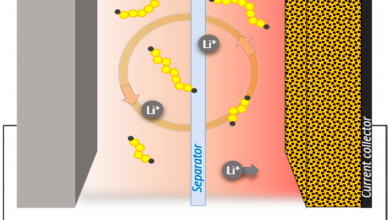
شکل6 نشاندهندهی این حقیقت است که لایهی محافظ، دور تا دور ساختار S8@CB را گرفته است ویک ساختار محافظت شدهای را برای ما فراهم میکند. در این ساختار، زمانی که پلی سولفیدها در هنگام دشارژ باتری، ساخته شوند، این لایهی محافظ، مانع از خروج این پلیسولفیدها شده و پلیسولفیدها، بدون وارد شدن به درون الکترولیت، لیتیوم را در خود ذخیره میکنند.
ضخامت این لایه برابر با 7 نانومتر است که یک ضخامت بسیار کم است و همچنین این لایه علاوه بر پایداری بسیار خوب در هنگام شارژ و دشارژ، با لیتیوم واکنش داده و با ایجاد یک ساختار قطبی، پلیسولفیدها را در اطراف خود نگه میدارد و علاوه بر جلوگیری از خروج پلیسولفیدها، لایهای با پذیرندگی بسیار خوب برای لیتیوم است. در شکل6 مراحل ساخت این ساختار را میبینیم که مشاهده میشود با اضافه شدن سولفور به کربن بلک، رنگ ماده به قهوهای میگراید و با پوشاندن لایهای از NNH، این ماده به رنگ قهوهای روشن تبدیل میشود.
همچنین در این شکل، تصاویر SEM از این ماده را در سه مرحلهی ساخت با بزرگنمایی مختلف، مشاهده میکنیم. شکل7، نمودار ظرفیت را در دو حالت با لایهی محافظ و بدون لایهی محافظ، با یکدیگر مقایسه میکند که تعداد سیکل کاری برای این باتری، بسیار شگفتانگیز است. در این شکل، ظرفیت ساختار S8@CB@NNH در سیکل 500، نزدیک به 1200mAh/g است که این یک ظرفیت بسیار خوب برای سولفور است.

لازم به ذکر است که ظرفیت ساختار S8@CB با افزایش تعداد سیکل، افت میکند و عملکرد آن به کلی مختل میشود. در این شکل، بازده کلومبی دو ساختار نیز با یک دیگر مقایسه شده است و ملاحظه میشود که ساختار S8@CB@NNH بازده بسیار خوبی دارد و بعد از گذشت زمان، عملکردش مختل نمیشود.
نکتهی جالب برای این شکل، این است که در ساختار پیشنهادی برای این مقاله، میزان سولفور استفاده شده، دو برابر حالت بدون لایهی محافظ است که این نشاندهندهی قدرت خیرهکننده برای این ساختار Core/Shell است. در قسمت «ب» از این شکل، میبینیم که حتی افزایش جریان، عملکرد باتری را مختل نکرده و با برگشتن به جریان اولیه، ظرفیت این باتری، حفظ شده است.

در کل، این ساختار با اضافه شدن یک لایه از جنس Ni3(NO3)2(OH)4 به ساختار S8@CB، عملکردی متفاوت را از خود به نمایش گذاشت که این عملکرد مدیون گیر افتادن پلیسولفیدها درون ساختار پیشنهادی است.
از این قبیل مثالها بسیار است. برای مثال در نمونهای دیگر، این بار با لایهای از جنس MnO2، سولفور را پوشاندند و این کاتد، به تعداد 800 سیکل کاری، ظرفیتی معادل 400mAh/g را فراهم کرد که این ظرفیت در مقدار مادهی فعال 1.5 میلیگرم به دست آمد ولی برای پرهیز از مطالب تکراری، از آوردن آن خودداری میشود.
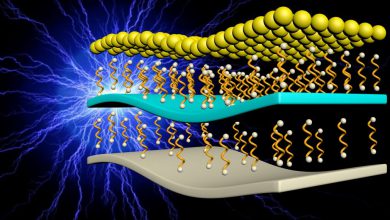
در مقالهای که در سال 2014 توسط آقای Zhi Wei Seh نوشته شد، به جای استفاده از سولفور، از Li2S به عنوان مادهی فعال استفاده گردید. در این مقاله، نکتهی جالب توجه، ظرفیت 780mAh/g در جریان 4C بود که یک رکورد بسیار خوب در این زمینه است و احتمالا این ویژگی باعث شد که این مقاله در ژورنال نیچر کامونیکیشن چاپ شود. شکل 8 کلیات مربوط به این ساختار را نشان میدهد. این ساختار دارای پوششی از جنس تیتانیوم سولفید است که هدایت الکتریکی بسیار خوبی حتی بهتر از کربن بلک دارد که میتوان گفت که این پوشش فلزی، باعث شده است که این چنین جریان خوبی را برای باتری فراهم آورد.
برای سنتز ساختار Li2S@TiS2 ابتدا، پودر لیتیوم سولفید را با تیتانیوم تترا کلراید واکنش میدهند تا یک لایه از تیتانیوم سولفید بر روی پور لیتیوم سولفید تشکیل شود. سپس با حرارت دادن در دمای 400 درجه سانتیگراد، یک لایهی کریستالی از جنس TiS2 خواهیم داشت که دور تا دور پودر Li2S را گرفته است و به عنوان یک لایه محافظ عمل میکند. همچنین ماهیت قطبی بودن پیوند M-S نیز با جذب کردن پلیسولفیدها، از حل شدن این فراوردههای واکنش دشارژ جلوگیری میکند. این آزمایش در مقدار 4.8 میلیگرم بر واحد سطح از ماده Li2S انجام شده است که مقدار بالایی است.

شکل 9 نمودارهای مربوط به ظرفیت را در جریانهای مختلف نشان میدهد که همانطور که گفته شد، ظرفیت در جریان بالا برای این کاتد بسیار عدد خوبی است و ظرفیت در جریان 4C در حدود 540mAh/g برای Li2S است که تقریبا مقدار آن همخوانی دارد با 780mAh/g برای سولفور. همچنین این کاتد، تعداد 400 سیکل کاری را سپری کرده و مقدار ناچیزی از ظرفیت خود را از دست داده است.
در قسمت «ج» از شکل 9 ظرفیت بر واحد سطح را مشاهده میکنیم که در جریانهای مختلف رسم شده است و تقریبا نتایج قابل قبولی را ارائه میکند. تکرار این نکته خالی از لطف نیست که پوشش TiS2 با گیر انداختن پلیسولفیدها، چنین نتیجه خوبی را برای کاتد Li2S به ارمغان آورده است.