باتری های لیتیوم سولفور چگونه کار میکنند.
مقدمه:
در قسمت قبل به اهمیت سولفور پرداختیم و دیدیم که سولفور یک ماده شگفتانگیز برای کاتد باتریهاست که میتواند در آیندهی نزدیک، بازار جهانی را به شدت تحت تاثیر قرار دهد. در این قسمت قصد داریم که به نحوهی عملکرد سولفور بپردازیم و بدانیم که در هنگام شارژ و دشارژ باتری، چه فرایندهایی در حال رخ دادن هستند و همچنین در ادامه یک سری از مشکلات کاتد سولفور را بیان میکنیم و میبینیم که این مشکلات چگونه از صنعتی شدن این کاتد جلوگیری کرده است.
سولفور چیست:
سولفور نام لاتین گوگرد است که این ماده در گروه ششم از جدول تناوبی قرار دارد و بالای این عنصر، اکسیژن قرار میگیرد. گوگرد یک نافلز بد بو، بدمزه و چند ظرفیتی است که بیشتر به شکل بلورهای زرد رنگ موجود در کانیهای سولفید و سولفات مشاهده میشود. گوگرد عنصری مهم برای همهی موجودات زنده است که برای مثال میتوان به وجود گوگرد در ساختار آمینواسیدها و پروتئینها اشاره کرد. این عنصر به صورت اولیه در کودها استفاده میشود ولی به صورت گستردهتر در باروت، ملیّنها، کبریتها وحشرهکشها نیز به کار گرفته میشود.
ظاهر این نافلز به رنگ زرد کمرنگ میباشد که بسیار سبک و نرم است. این عنصر به هنگام ترکیب با هیدروژن، بویی شبیه به بوی تخممرغ فاسد شده دارد. گوگرد با شعله آبی رنگ سوخته و بوی عجیبی از خود ساطع میکند.

گوگرد بیشتر از هر عنصر دیگری، سی آلوتروپ جامد دارد که مشهور ترین آنها و همچنین فراوانترین آنها، S8 است که به صورت یک حلقه هشت تایی از اتمهای گوگرد تشکیل میشود. حلقههایی با تعداد اتمهای متفاوت نیز برای این عنصر وجود دارد برای مثال حلقههای هفت تایی و شش تایی از دیگر آلوتروپهای این عنصر هستند که رنگ حلقهی هفتایی، کمی تیره تر از حالت معمول خود است.

عملکرد کاتد سولفور
در قسمت قبل فهمیدیم که سولفور بیشتر به صورت یک حلقهی هشتتایی از اتمهای عنصر گوگرد مشاهده میشود که این ماده قابلیت ذخیره کردن اتمهای لیتیوم را دارد که این خاصیت سولفور، موجب شده است که محققان به فکر استفاده از این ماده به عنوان یک کاتد برای باتریهای لیتیوم یون بیفتند.
با ورود لیتیوم به درون ساختار هشتتایی سولفور، این حلقه شکسته شده و لیتیوم به صورت دو اتم جداگانه به دو طرف این زنجیره اضافه میشود و این چنین لیتیوم در اولین مرحلهی ذخیره شدن در کاتد (دشارژ) جای میگیرد. این عملیات میتواند با شکستن زنجیرهی گوگرد ادامه پیدا کند و زنجیر اولیه کوچکتر شود. این فرایند با اضافه شدن دوبارهی لیتیوم به زنجیرهی هشتایی ادامه پیدا میکند و زنجیرهی اولیه میشکند و به قطعات کوچکتر تقسیم میشود. شکل 2-4 به خوبی این فرایند را توضیح میدهد.
در هنگام خارج شدن لیتیوم از کاتد (هنگام شارژ)، این مراحل برعکس رخ داده و زنجیرههای کوچکتر با ترکیب شدن با یکدیگر، به زنجیره¬های بزرگتر تبدیل میشود. در شکل 2-4 دو فراورده نهایی در هنگام دشارژ را مشاهده میکنیم که این دو فراورده به صورت جامد هستند ولی پلیسولفیدها، در الکترولیتهای معمول قابلیت انحلال دارند. دو فراورده نهایی یعنی Li2S و Li2S2 همانند سولفور، نارسانا هستند و الکترونها را به راحتی از خود عبور نمیدهند.
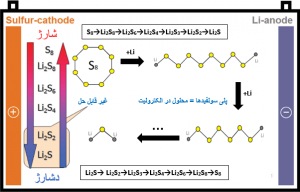
لازم به ذکر است که به دلیل حل شدن پلیسولفیدهای لیتیوم در الکترولیت، در محلول الکترولیت این پلیسولفیدهای لیتیوم به پلیسولفید و یون لیتیوم تفکیک میشوند که بار پلیسولفیدها، به دلیل گرفتن الکترون اتم لیتیوم، منفی است.
فرایند شارژ و دشارژ ذکر شده در بالا، بسیار ساده بیان شده است و این فرایندها، میتوانند بسیار پیچیدهتر رخ دهند. شکل 2-5 یک بررسی دقیق از میزان ولتاژ و انرژی فراوردههای ایجاد شده در کاتد سولفور را نشان میدهد که این نمودار نحوهی تغییر ولتاژ برای فراوردهها را نیز به تصویر میکشد. ملاحضه میشود که به دلیل عدم واکنش سولفور با لیتیوم، ولتاژ سولفور بیشترین مقدار را دارد. در حالی که فراوردهی نهایی یعنی Li2S کمترین ولتاژ را به خود نسبت داده است.
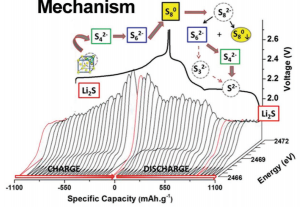
همان طور که از شکل 2-5 مشخص است، فرایند دشارژ، پیچیدگیهای بیشتری نسبت به فرایند شارژ دارد. شکل بالا نکات بسیار زیادی را در خود جای داده است که برای جلوگیری از پیچیدگی، از بیان آنها خودداری میشود.
مشکلات کاتد سولفور:
همان طور که بیان شد، فراوردههای واکنش سولفور و لیتیوم یعنی پلیسولفیدها، در الکترولیتهای معمول قابل حل شدن هستند که این یک مشکل بسیار بزرگ است. این اتفاق پیامدهای بسیاری را به همراه دارد و از مهمترین پیامدهای حل شدن پلیسولفیدها درون الکترولیت، کم شدن مادهی فعال کاتد یعنی سولفور است که با کم شدن سولفور، دیگر مادهای برای ذخیره کردن اتمهای لیتیوم وجود نخواهد داشت که این خود مشکل بسیار بزرگی محسوب میشود. این مشکل باعث میشود که نمودار ظرفیت باتریهای لیتیوم سولفور در سیکلهای اول به شدت افت کند و ظرفیت بسیار کمی را در اختیار ما قرار دهد.
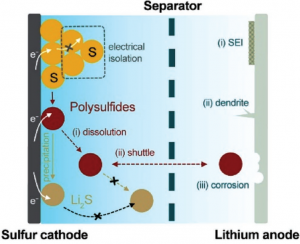
از دیگر پیامدهای حل شدن پلیسولفیدها درون الکترولیت، رفتن پلی سولفیدها به سمت آند است که این اتفاق به دلیل گرادیان غلظتی در پلیسولفیدها اتفاق میافتد. به عبارت ساده تر، به دلیل زیاد بودن پلی سولفیدها در سمت کاتد، این پلیسولفیدها تمایل دارند که به سمت آند نفوذ کنند و با رفتن به سمت دیگر باتری، عملا ماده ذخیره کننده لیتیوم یعنی سولفور، از دسترس خارج میشود.
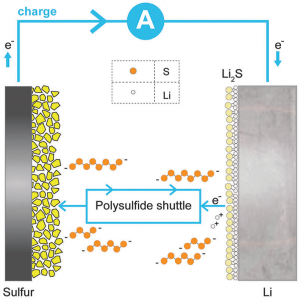
شکل 2-6 به خوبی نشان میدهد که با رفتن پلیسولفید ها به سمت آند، این پلی سولفیدها با ایجاد یک لایه بر روی آند، مانع از ورود و خروج راحت لیتیوم به آند میشوند که این باعث عملکرد ضعیف باتری لیتیوم سولفور میگردد. مطابق شکل 2-6، پدیدهی شاتل (Shuttle) در باتریهای لیتیوم سولفور بسیار شایع است. دراین پدیده، پلی سولفیدها در هنگام شارژ و دشارژ، مدام در بین کاتد و آند در رفت و آند هستند و این یعنی سولفور به جای این که در باتری نقش مادهی فعال را داشته باشد، نقش یک مادهی بیفایده را در باتری ایفا میکند.
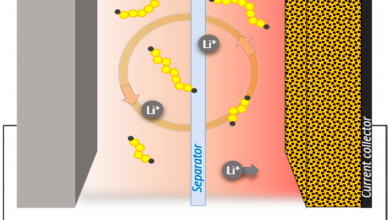
از چالشهای دیگر این باتریها، نارسانا بودن سولفور و دو فراورده نهایی یعنی Li2S و Li2S2 است که موجب میشود در حین انتقال بار از سمت آند به سمت کاتد و یا از سمت کاتد به سمت آند توسط مدار خارجی، با مشکل جدی مواجه شویم زیرا این مواد به دلیل نارسانا بودن، الکترون را به خوبی از خود عبور نداده و مقاومت زیادی در باتری ظاهر میشود. در شکل 2-7 میتوان این موضوع را به راحتی مشاهده کرد. الکترون از طریق جمعکننده جریان به راحتی به سمت محل واکنش انتقال نمیابد و ظرفیت از این طریق بسیار افت خواهد کرد. این مشکل باعث میشود که نتوان از مقدار زیادی سولفور جهت ذخیره لیتیوم استفاده کنیم زیرا مقدار زیاد سولفور باعث میشود که ذرات سولفور بر روی هم بنشینند و انتقال الکترون در لایههای بالاتر به راحتی انجام نگیرد.
مقدار کم سولفور نیز از صنعتی شدن سولفور نیز جلوگیری میکند زیرا مقدار کم سولفور، باعث میشود که ما برای دستیابی به انرژی مورد نظر، حجم بیشتری را برای باتری خود انتخاب کنیم تا جرم مورد نظر سولفور بیشتر شود. در قسمت بعد در این رابطه بیشتر توضیح داده خواهد شد.
استفاده از جرم زیاد سولفور در باتری:
در قسمت قبل، اشارهی کوچکی به این موضوع شد که اگر بخواهیم انرژی مورد نیاز خود را با باتری تامین کنیم، نیاز است که مقدار زیادی از سولفور را در باتری استفاده کنیم زیرا هر چه سولفور موجود در کاتد بیشتر باشد، میزان بیشتری از لیتیوم نیز میتواند در سمت کاتد، قرار بگیرد و در نتیجه، باتری به میزان بیشتری میتواند دشارژ شود که این یعنی، ما توانستهایم که انرژی بیشتری را از سمت آند آزاد کنیم پس انرژی قابل استفاده بیشتر میشود.
اما همانطور که گفته شد، استفاده از حجم زیاد سولفور، مشکلات را چندین برابر میکند زیرا همان طور که در قسمت قبل اشاره شد، سولفور و فراوردههای نهایی آن، رسانایی خوبی ندارند و مطابق شکل 2-7، اگر بخواهیم میزان زیادی از سولفور را بدون اندیشیدن تمهیداتی، استفاده کنیم، با مشکل واکنش کند لیتیوم با سولفور مواجه هستیم.
این مشکل به دلیل نرسیدن الکترون آمده از سمت آند به محل واکنش است زیرا در مسیر حرکت الکترون، سولفور و فراوردههای آن وجود دارد که اجازهی حرکت به سمت ناحیه واکنش را به الکترون نمیدهند. در صورت استفاده از مقدار کم سولفور، مجبوریم که برای تامین ماده فعال مورد نیاز باتری، سولفور را به صورت تکلایه و در حجم زیاد استفاده کنیم که مشخص است با این کار، حجم نهایی باتری به شدت زیاد افزایش خواهد یافت.
با زیاد شدن حجم باتری، وزن آن نیز به دلیل وزن بدنه و دیگر متعلقات آن زیاد خواهد شد که در این صورت، با مشکل کاهش انرژی عملی بر واحد جرم روبه رو میشویم. در شکل 2-8 سه نمودار مختلف از نسبت جرم الکرولیت به جرم سولفور را نشان میدهد. در این شکل، ملاحظه میشود که هر چه مقدار سولفور زیادتر شود، مقدار انرژی بر واحد حجم نیز بیشتر میشود که این افزایش نیز با افزایش مقدار سولفور نسبت به الکترولیت، خود را بهتر نشان میدهد.
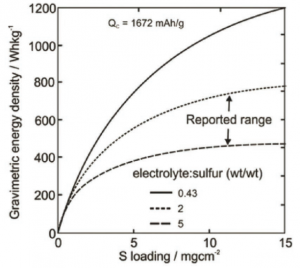
برای این که باتریهای لیتیوم سولفور، جای خود را در صنعت باز کنند، نیاز دارند که دو شرط مهم را برآورده کنند. این دو شرط، عبارت است از انرژی بیشتر از 400Wh/kg و ظرفیت سطحی بالاتر از 4mAh/cm2 که برای برآورده کردن این دوشرط، نیاز است که مقدار سولفور مورد استفاده به مقدار بیشتر از 2mg/cm2 برسد. با این کار میتوان مطمئن شد که این باتریها آمادهی ورود به بازار هستند اما با زیاد شدن مقدار سولفور، مشکلاتی که قبلا بحث شد، خود را بیشتر و شدیدتر نشان میدهد که برای دور زدن این مشکلات، نیاز است که ما تمهیدات ویژهای را در نظر بگیریم. در فصل بعد، تعدادی از کارهای اخیر را که در جهت دور زدن این مشکلات به کار رفته است، بررسی میکنیم و میبینیم که ایدههای ساده، نتایج فوقالعادهای را در اختیار ما قرار خواهد داد.


سلام و خسته نباشید.
امکانش هست مرجع این متن ها را بفرمایید؟
سلام خدمت شما. مقالات آموزشی باتری لیتیوم سولفور در 6 مقاله آموزشی تقسیم شده است که از منابع مختلفی استفاده شده.
اما دو منبع اصلی آن به صورت زیر می باشد:
مقاله اول: Review on High-Loading and High-Energy Lithium–Sulfur Batteries
مقاله دوم: Review on Li-Sulfur Battery Systems: an Integral Perspective