بررسی مقالات باتریهای لیتیوم سولفور(قسمت سوم)
کاتدهای بر پایه ی کربن
در این نوع از کاتدها، ساختارهای کربنی از جمله، نانولولههای کربنی، نانوفیبرها و ساختارهای متنوع دیگر از کربن، نقش یک جمع کنندهی جریان را دارند که همانند یک اسکلت محکم، اجزای باتری را کنار هم نگه میدارند. در این قسمت به دو نمونه از این کاتدها بر میخوریم که ایدههای جالبی درون این مثالها نهفته است و با بررسی دقیق میتوانیم از این ایدهها استفاده کنیم.
در مقالهای که در سال 2018 در مجلهی ACS چاپ شد، آقای Arvinder Singh، با بهرهگیری از نانوفیبرهای کربن، توانست نتایج خوبی را برای باتریهای لیتیوم سولفور به دست آورد. در این مقاله، ابتدا نانوفیبرهایی را توسط روش الکترواسپینینگ سنتز کردند که مادهی استفاده شده در این روش، یک ژل زرد رنگ از ایزوپروپوکساید(TiP) و پلیوینیلپیرولیدون(PVP) درون اتانول و استیک اسید بوده که اگر این نانوفیبرهای به دست آمده از این ژل را به ترتیب در دماهای 600 و 900 درجه به مدت سه و شش ساعت درون محیط نیتروژن گرمادهی کنیم، ساختارهای TiO2/CNF و TiO/CNF به دست میآید.
شکل10، عملیات سنتز را به صورت کامل نشان میدهد و کاملا مشخص است که در شکل نهایی، ساختارهایی نقطه مانند از TiO، بر روی نانوفیبرهای کربن، ایجاد شده است.

قسمت «الف» از این شکل، ساختار شیمیایی مادهی مورد استفاده جهت استخراج نانوفیبرها را نشان میدهد که تقریبا ترکیب شیمیایی پیچیدهای را دارد و از پرداختن به جرئیات آن صرفه نظر میشود.
در قسمت «ب» از شکل 10 همان طور که اشاره شد، مراحل آماده سازی ساختار TiO/CNF آورده شده است و توضیحات اضافی پیرامون آن داده نمیشود و شکل گویای همهی مطالب است. بعد از آماده سازی شاکلهی الکترود، به سراغ مرحلهی بعد یعنی اضافه کردن سولفور میرویم که این مرحله نیز همانند قسمت قبل این آزمایش، جذابیتهای مخصوص به خود را دارد.
در این مرحله، ابتدا مقداری از سولفور را بر روی این ساختار که از مرحلهی قبل آماده شده است، میریزیم و طی یک عملیات حرارتی بسیار سریع (پنج ثانیه) سولفور را درون اسکلت کربن خود نفوذ میدهیم. در این فرایند گرمادهی، سولفور به درون ساختار نفوذ کرده آمادهی تستهای اولیهی باتری میشود.
نکتهی بسیبر مهم در این آزمایش، خالی بودن پیوند دوم تیتانیوم در TiO است که در این ساختار، به دلیل نبود اکسیژن دوم در ساختار نهایی، تیتانیوم قادر است که با گرفتن الکترون اضافی، با یک مادهی دیگر، واکنش دهد که این ماده میتواند پلیسولفید باشد.
به عبارت دقیقتر، هنگام تشکیل پلیسولفید، تیتانیوم با تشکیل پیوند با این پلیسولفیدها، مانع از حل شدن آنها درون الکترولیت میشود و تیتانیوم همانند یک دست، این پلیسولفیدها را کنار خود نگه میدارد. علاوه بر جذب پلیسولفیدها، TiO مزیت دیگری نسبت به TiO2 دارد و آن هدایت الکتریکی بهتر این ماده است که باز به دلیل وجود جای خالی اکسیژن در این ساختار است.

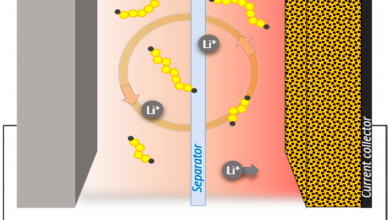
شکل 11 به صورت دقیقتر این موضوع را که جذب پلیسولفیدها توسط TiO انجام میگیرد، نشان میدهد و کاملا واضح است که دو اکترون پلیسولفید به سمت تیتانیوم کشیده میشود. لازم به ذکر است که وجود حصارهای CNF نیز علاوه بر افزایش هدایت الکتریکی، مانع از خروج پلیسولفیدها به سمت الکترولیت شده و این حصارهای بینظیر، ظرفیت باتری را به طور قابل ملاحظهای افزایش میدهند و همچنین سطح لازم برای انجام واکنش را نیز فراهم میآورد.
این آزمایش برای اکسید تیتانیوم هم قابل انجام است اما همان طور که اشاره شد، به دلیل هدایت الکتریکی کم(چون اکسید است) و عدم جذب پلیسولفیدها، بستر مناسبی برای این آزمایش نیست. در شکل 13، نمودارهای مختلف را از عملکرد سلهای ساخته شده، به نمایش گذاشته شده است و در دو نمودار اول، ظرفیت در دو جریان 0.1C و 0.2C آمده و ملاحظه میکنیم که چه ظرفیت خوبی را در اختیار ما قرار میدهد.
در قسمت «ج» از شکل13، چهار حالت مختلف را میبینیم که با یک دیگر مقایسه شداند و به راحتی قابل تشخیص است که عملکرد ساختار مورد بررسی در این مقاله، بسیار متفاوت بوده و کارایی باتری را بهبود بخشیده است. در این نمودار، حالتهای CNF-S و TiO2/CNF-S مورد بررسی قرار گرفتهاند و با حالت TiO/CNF-S مقایسه شدهاند و میبینیم که ظرفیت باتری چند برابر شده است.
همان طور که اشاره شد، اکسید تیتانیوم نسبت به منواکسید تیتانیوم، هدایت اکتریکی خوبی نداشته و همچنین از حل شدن پلیسولفیدها نیز جلوگیری نمیکند و میتوان انتظار داشت که عملکرد بسیار ضعیفی را از خود نشان دهد و نتایج نیز، این نکته را تایید میکنند. این شکل وجود مادهی KNO3 درون الکترولیت رانیز بررسی کرده که در ادامهی این گزارش، به آن میپردازیم.

به طور کلی، این مقاله بر روی دو نکته استوار بود، اول این که منواکسید تیتانیوم، پلیسولفیدها را به خود جذب میکند و مانع از ورود آنها به درون الکترولیت میشود. دوم این که ساختار حصار مانند نانوفیبرهای کربن، مانع از خروج این پلیسولفیدها شده است.
درمقالهای دیگر، محققان چینی با ارائهی روشی که اصول آن همانند مقالهی قبل است، توانستند ظرفیت جرمی و سطحی بسیار خوبی را با جرم مادهی فعال زیاد، به دست آورند. دراین آزمایش، آنها با استفاده از یک فوم از جنس فیبر کربن میان تهی(hollow carbon fiber foam) که به HCFF معروف است، توانستند نتایج خارقالعادهای کسب کنند که در ادامه به این نتایج میپردایم. شکل 13 تصاویر میکروسکپ الکترونی را نشان میدهد و در تصویر اول نمای کلی این فوم را ملاحظه میکنیم.
در این آزمایش، این فیبر کربن، نقش جمعکنندهی جریان را دارد و هنگام مبادلهی الکترون، نقش کلیدی ومهمی را ایفا میکند. در ادامه، آنها با اضافه کردن یک اسلاری(محلول غلیظ) از جنس پودر سولفور و نانولولههای چند دیواره و کربن بلک(CB) بر روی این فوم، یک کاتد را برای باتریهای لیتیوم سولفور مهیا کردند. در این ساختار، نانولوهای چند دیواره (MWCNT)، نقش بایدر را دارند و با نفوذ درون ساختار، علاوه بر بالا بردن هدایت الکتریکی مادهی فعال، اجزا را کنار یکدیگر نگه میدارد.

فوم مورد استفاده در این آزمایش، به دلیل داشتن تخلخلهای زیاد، الکترولیت را درون خود نگه میدارد و هنگامی که پلیسولفید درون الکترولیت حل شد، با حبس الکترولیت، مانع از نفوذ پلیسولفیدها به سمت آند میشود. در اینجا لازم است که دوباره تاکید شود که این ساختار، پلیسولفیدها را به واسطهی حبس الکترولیت، در سمت کاتد نگه میدارد و بدون ایجاد پیوند با پلیسولفید، از نفوذ آنها به سمت آند ممانعت به عمل میآید.
شکل14 به صورت کاملا واضح نشاندهندهی فرایند حبس پلیسولفیدها است که به کمک گیر افتادن الکترولیت، این فرایند انجام میشود. همچنین شکل 15 مفهوم بهتری را از بیان بالا ارائه میکند. در این شکل واضح است که اسلاری سولفور و نانولولههای کربنی، درون این فوم از جنس فیبر کربن نفوذ کرده است و کاتد مورد نظر را ساخته است. این روش، یک روش بسیار ساده و با هزینهی اندک است که حتی میتوان از این ایده در دیگر کارها استفاده کرد.


در نهایت شکل 16 نشان دهندهی برتری این روش نسبت به دیگر روشهای معمول را نشان میدهد و ملاحظه میکنیم که چه ظرفیت بالایی و با چه جرمی از مادهی فعال، به دست آمده است. در این نمودار، جرم مادهی مورد استفاده، 21mg/cm2 است که ظرفیتی معادل با 12mAh/cm2 برای ما به ارمغان آورده است که علاوه بر فراهم کردن شرایط صنعتی شدن، ارزان نیز میباشد که میتواند نمایندهی خوبی برای تحقیق بر روی یک باتری صنعتی باشد.
شکل 17 نیز یک مقایسه بین این مقاله و دیگر مقالات انجام داده است که تقریبا گویای همه چیز است و میتوان گفت که از هر لحاظی از دیگر مقالات مقایسه شده در این مقاله، یک سر و گردن بالاتر است. در این شکل، دو ظرفیت سطحی و ظرفیت جرمی را با یک دیگر مقایسه کرده و به دست آوردن اینچنین نتیجهی شگفتانگیزی، مدیون فراهم کردن سطح بسیار زیاد فوم فیبر کربنی هستیم.
در این مقاله دیدیم که به کمک فومی از جنس فیبر کربن، و ریختن یک محلول غلیظ از جنس پودر سولفور و نانولولههای کربنی چند دیواره، یک کاتد به دست آمد که ظرفیت بسیار خوبی را برای ما فراهم کرده و گفتیم که این نتایج مدیون محصور شدن الکترولیت درون فوم کربنی است که دیگر اجازهی نفوذ پلیسولفیدها را به سمت آند نمیدهد.