مقدمه:
در این قسمت میخواهیم عملکرد کلی باتری سرب اسید را به صورت مختصر بیان کنیم و ببینیم که چرا باتریهای سرب اسید به عنوان یک باتری قابل شارژ شناخته میشوند. در مقالهی قبل دیدیم که باتریهای سرب اسید از چهار قسمت کلی تشکیل میشوند که دو الکترود مثبت و منفی، دو قسمت کلیدی این باتری است که مبنای عملکرد باتریهای سرب اسید را تشکیل میدهد.
ولتاژ تئوری:
بطور کلی اختلاف ولتاژ ایجاد شده به کمک یک سلول از الکترودهای مثبت و منفی در باتریهای سرب اسیدی حدود ۲ تا ۲٫۱ ولت است. لذا ولتاژهای بالاتر مثل ۱۲ ولت از اتصال سری چندین سری از الکترودهای مثبت و منفی تشکیل میشود.
قطر صفحات مثبت و منفی نقش اساسی در تعیین ظرفیت باتری بازی میکنند. اغلب برای کاربردهای با ظرفیت معمول همچون باتریهای استارتر خودرو قطر این صفحات کمتر از ۲ میلی متر است. اما در کاربردهایی با قابلیت شارژدهی طولانی، قطر الکترودها به ۶ میلی متر نیز خواهد رسید.
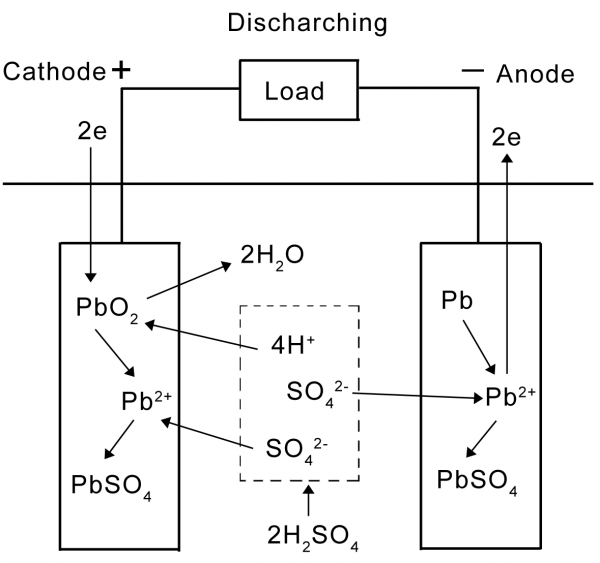
روند دشارژ:
در روند دشارژ، الکترود مثبت الکترون را از مدار بیرونی به سمت خود جذب کرده و این الکترونها با مواد فعال موجود در قطب مثبت و یونهای موجود در الکترولیت، یک واکنش شیمیایی را آغاز میکنند که این واکنش در فرمول زیر نمایش داده شده است:
PbO2 + HSO4– + 3H+ + 2e– → PbSO4 + 2H2O
همانطور که دیده میشود الکترون دریافت شده از مدار بیرونی و یونهای موجود در الکترولیت باعث تولید سولفات سرب (PbSO4) و آب در اطراف قطب مثبت میشوند. اکسید سرب (PbO2) که ماده فعال قطب مثبت محسوب میشود بتدریج به سولفات سرب تبدیل شده و در نهایت کل سطح قطب مثبت را فرا خواهد گرفت و در آن هنگام دیگر باتری جریان نمیدهد.
در طی این واکنش خاصیت اسیدی محلول الکترولیت به تدریج از بین میرود و آب جای آن را میگیرد. تبدیل اسید به آب یکی از ویژگیهای جالب باتریهای سرب اسیدی است و هر چه باتری دشارژ میشود اسید باتری مصرف شده و آب جای آن را میگیرد پس میتوان به راحتی با اندازه گیری اسیدیته محلول الکترولیت، باتری پی به سطح شارژ آن برد. همانطور که شاید دیده باشید بعضی از باتریهای ماشین دارای یک نمایشگر سطح شارژ هستند که در واقع شبیه یک کاغذ تورنسل، سطح اسیدیته را با رنگهای مختلف نشان میدهد.
در مجاورت قطب منفی واکنش دیگری در حال اتفاق است. سرب موجود در قطب منفی با یون های HSO4– وارد واکنش میشود و نتیجه آن تولید سولفات سرب و الکترون آزاد است که این واکنش را اکسیداسیون سرب نیز مینامند. واکنش زیر بیانگر این اتفاق است:
Pb + HSO4– → PbSO4 + H+ + 2e–
مطابق این واکنشها، در انتهای پروسه دشارژ سطح هر دو قطب بطور کامل با سولفات سرب (PbSO4) پوشیده شده و الکترولیت، خاصیت اسیدی خود را از دست میدهد.
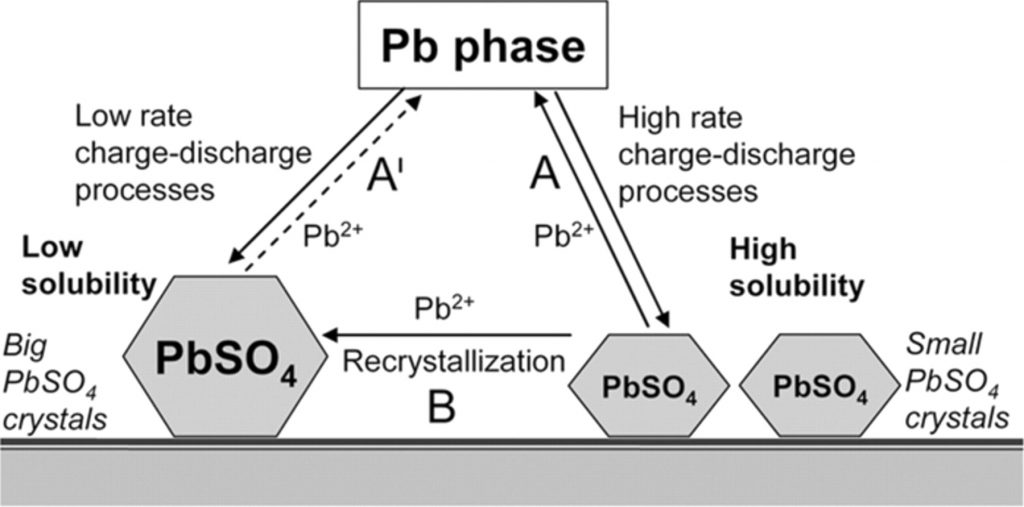
سولفاته شدن:
مولکولهای سولفات سرب علاقه زیادی به تشکیل کریستالهای بزرگ و سخت دارند که پس از تشکیل، بدلیل بزرگی دیگر تمایلی به برگشتپذیری ندارند و در واکنشهای شارژ شرکت نمیکنند. به همین دلیل اغلب توصیه میشود که باتریهای سرب اسیدی در حالت دشارژ نگهداشته نشوند.
این نکته دلیل همان توصیهای است که اسرار دارد زمان انبارداری باتریهای سرب اسیدی نباید بیشتر از ۶ ماه باشد چرا که محلول الکترولیت باتری و الکترودهای مثبت و منفی حتی در زمانی که باتری به مدار بیرونی متصل نیستند، میتوانند واکنشهای بالا را درون محیط باتری البته با سرعت کمتری انجام دهند و در نتیجه پس از گذشت مدت زمانی، باتری دشارژ شده و سولفات سرب سطح قطبها را پر میکند (همانطور که گفته شد به این پدیده خود دشارژی یا Self Discharge میگویند).
حال اگر باتریها مجددا شارژ نشوند، سولفات سرب تبدیل به کریستالهایی خواهد شد که دیگر در واکنشهای شیمیایی شرکت نمیکند و باتری از بین خواهد رفت. مهمترین عامل تشکیل اینگونه سولفاتها روند نامناسب دشارژ و اغلب دشارژهایی تا ولتاژ پایین و عدم شارژ مناسب باتری است. گرچه دشارژ با جریانهایی با پیک بالا نیز ممکن است به این پدیده منجر شود.
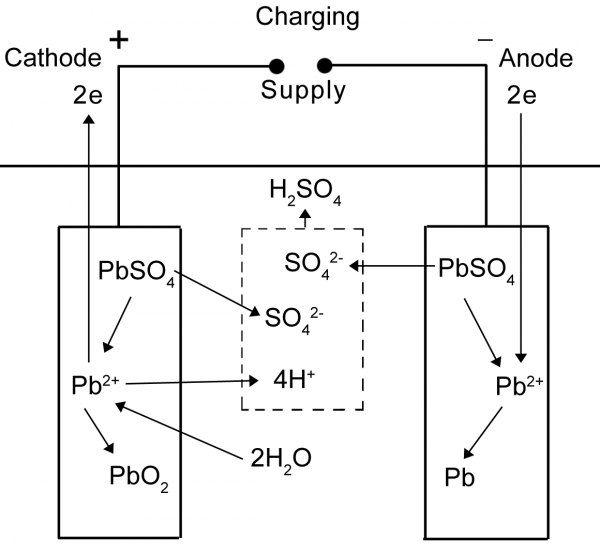
روند شارژ:
این روند کاملا عکس روند دشارژ است، در قطب مثبت از ترکیب آب و سولفات سرب، اکسید سرب و یونهای هیدروژن متصاعد میشود که واکنش زیر این فرایند را نشان میدهد:
PbSO4 + 2H2O → PbO2 + HSO4– + 3H+ + 2e–
در قطب منفی نیز یونهای هیدروژن تولید شده از رابطه قبل، به همراه سولفات سرب وارد واکنش شده و مجددا سرب و یون HSO4- تولید میکنند.
PbSO4 + H+ + 2e– → Pb + HSO4–
همانطور که دیده میشود روابط شارژ و دشارژ کاملا عکس یکدیگر بوده و در نتیجه به باتری قابلیت شارژ و دشارژ مداوم را میدهد.
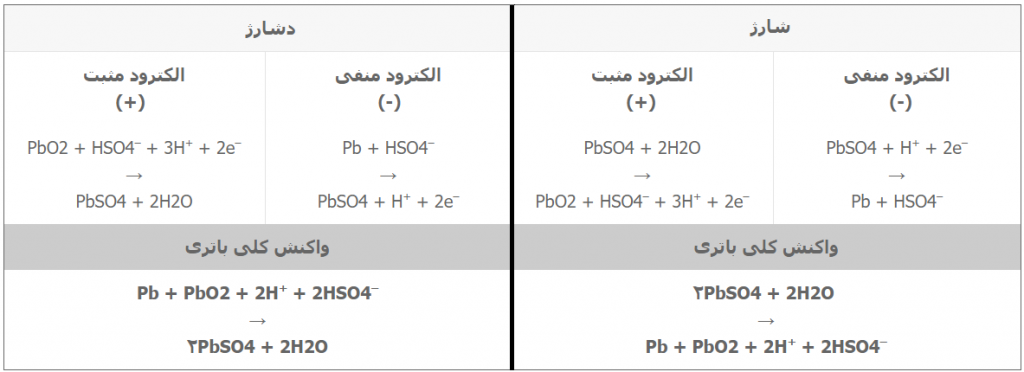
در جدول زیر خلاصهای از روابط شیمیایی رخ داده در قطبها مثبت و منفی در هنگام شارژ و دشارژ آورده شده است.
در کنار این دو واکنش پدیده دیگری نیز در فاز شارژ رخ میدهد که منجر به تولید گاز هیدروژن در اطراف قطب منفی و گاز اکسیژن در مجاورت قطب مثبت میشود. این گازها برخلاف یونها، فرار بوده و با خارج شدن از محیط باتری باعث کم شدن آب باتری خواهد شد.
اگر چگالی این گازها در محیط افزایش یابد، قابلیت انفجار دارند و به همین دلیل است که فضای باتری خانهها باید از تهویه مناسبی برخوردار باشد. این پدیده یکی از دلایل لزوم وجود تهویه مناسب است. تنظیم ولتاژ شارژر و بالا نبودن آن تاثیر بسزایی در کنترل این پدیده خواهد داشت.
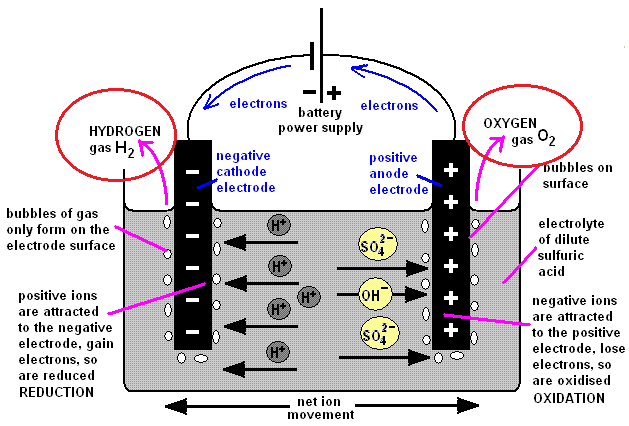
مهمترین عامل این پدیده، یونیزه شدن آب به کمک جریان شارژ میباشد. همانطور که گفته شد باتری در حالت دشارژ شده سرشار از آب است و برای شارژ آن نیز نیاز به اعمال ولتاژ بیرونی به دو قطب است. در هنگام شارژ، همواره بخشی از مولکولهای آب بدلیل وجود این ولتاژ یونیزه شده و گازهای هیدروژن و اکسیژن تولید میکنند:
2H2O → 2H2+O2
جمع بندی:
در این مقاله به عملکرد کلی باتری سرب اسید پرداخته شد و دیدیم که به دلیل برگشتپذیر بودن واکنشهای مربوط به باتری سرب اسید، این باتری یک باتری شارژپذیر است و میتوان از این باتریها در اتومبیلها استفاده کرد.
منبع: upsonline.ir





بسیار مفید بود و کاربردی.فقط جای کلمه ی آند و کاتد را در شکل و جدول اشتباه گذاشتید.آند قطب منفی و کاتد قطب مثبت است.
ممنون از تذکر شما. اشتباه تصحیح گردید