طیف سنجی امپدانس الکتروشیمیایی (EIS) برای باتریهای لیتیوم یون
مقدمه:
طیف سنجی امپدانس الکتروشیمیایی (EIS) یکی از مهمترین روشهای مشخصه یابی سیستمهای الکتروشیمیایی، از جمله سیستمهای ذخیره انرژی مانند باتری لیتیوم یون است. از روش EIS در زمینههای مختلف مانند اندازهگیری نرخ یا سرعت خوردگی، کاتالیست، ابرخازن و سلول سوختی میکروبی و سلولهای خورشیدی فوتوالکتروشیمیایی رنگدانهای استفاده میشود. به کمک EIS می توانیم اطلاعات دقیقی از داخل باتری لیتیوم یون به دست آوریم:
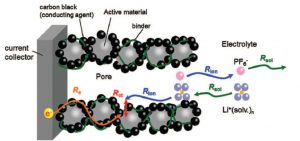
EIS مقاومت های سلول را توسط یک آزمایش، تعیین کرده و آن را کمی میکند. از جمله مقاومت بدنه (R_b)، لایه فصل مشترک (R_SEI)، مقاومت معادل واکنش انتقال بار (R_ct) و فرآیند نفوذ بار (W) . اندازهگیریهای EIS معمولاً در سیستم سه الکترودی انجام میشود.
مجموعه اندازهگیری EIS
کل مجموعه اندازهگیری، شامل سلول الکتروشیمیایی، مولد فرکانس، تحلیلگر پاسخ فرکانسی (FRA) و یک کامپیوتر است که برای کنترل آزمایش و ذخیره سازی اطلاعات استفاده میشود . همچنین در این آزمایش از پتانسیواستات برای کنترل پتانسیل الکترود استفاده خواهد شد. تحلیلگر پاسخ فرکانسی، قسمت اصلی این سیستم را تشکیل داده است که بخش حقیقی و موهومی امپدانس را محاسبه میکند . تفسیر طیف امپدانس، توسط یک مدل مدار معادل انجام میگیرد که خود از سلف، خازن، مقاومت و سایر المانها تشکیل شده است.
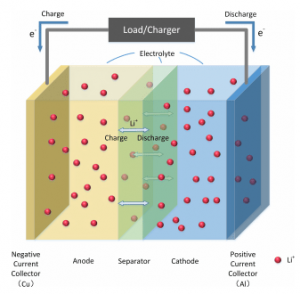
یک باتری لیتیوم یون از 4 عنصر زیر تشکیل شده است :
- یک الکترود مثبت (کاتد) یک الکترود منفی (آند)
- یک جداکننده بین کاتد و آند
- جمع کننده های جریان
- الکترولیت (نمک لیتیوم در یک حلال ترکیب آلی)
در طی واکنشهای الکتروشیمیایی، الکترونها و یونهای لیتیوم از میان هریک از عناصر باتری عبور میکنند که برای مدل سازی هر یک از اجزای سلول و سطوح تماس آنها از مولفههای الکتریکی مانند مقاومتها و خازنها استفاده میشود.
این عناصر مداری که مدل کنندهی اجزاء باتری هستند، بصورت سری یا موازی به هم متصل میشوند و یک مدل مداری باتری لیتیوم یون را تشکیل میدهند. مقدار امپدانس کل توسط اسکن فرکانس AC که معمولاً در محدوده 10mHz-100KHz است، انجام میشود.
اولین بار واربرگ فرایند نفوذ و پخش یون لیتیوم را در طیف امپدانس توسط عبارت ” امپدانس واربرگ” در فرکانس پایین در محدوده 10mHz-10Hz تفسیر کرد. امپدانس وابسته به واکنش انتقال بار در محدوده فرکانس میانی 10Hz-10kHz نسبت داده میشود و فرآیند انتقال درون لایه فصل مشترک (SEI) در فرکانس بالا یعنی 10kHz-100kHz اندازه گیری میشود. در ادامه با هر یک از این امپدانس ها بیشتر آشنا میشویم.
اساس طیف سنجی امپدانس الکتروشیمیایی (EIS)
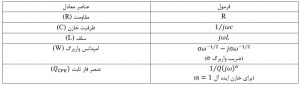
باتری یک ابزار الکتروشیمیایی است که انرژی شیمیایی را به الکتریکی تبدیل می نماید. EIS با اعمال ولتاژ AC به سیستم، تلفات داخلی متناسب با جریان بار را اندازه گیری میکند. مانند مقاومت (R)، ظرفیت خازنی (C)، القائیدگی (L). در این روش، یک ولتاژ سینوسی به مدار اعمال میشود . در نتیجه پاسخ به صورت یک جریان سینوسی برحسب تابعی از فرکانس اعمالی، اندازهگیری میشود.
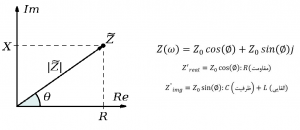
در مدل ساده ی مداری، روابط بین مقاومت، ولتاژ و جریان با اعمال ولتاژ DC(جریان مستقیم) ، مطابق با قانون اهم است در شکل3- الف نشان داده شده است. بطور مشابه با اعمال ولتاژ AC (جریان متناوب) به یک سلول الکتروشیمیایی ، امپدانس در مدار AC برابر است با: (Z(ω)= V(ω)⁄I(ω که معادل قانون اهم است. (ω=2πf فرکانس زاویه ای ولتاژ AC و f نیز فرکانس ولتاژ AC است). واژه امپدانس (Impedance) به مقاومتی که یک عنصر یا مدار به هنگام عبور جریان متناوب از خود نشان میدهد، اشاره دارد. بنابراین، امپدانس، از المان های سلفی، خازنی و مقاومتی تشکیل شده است و با سری و موازی کردن این المانها امپدانس تغییر میکند.
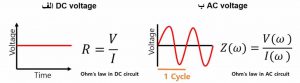
امپدانس و مقاومت
در یک سیستم واقعی، سلول الکتروشیمیایی شامل عناصر مداری مختلف با چینش متنوع است. بنابراین، استفاده از مفهوم امپدانس برای سیستم الکتروشیمیایی، بسیار دقیقتر از تنها یک مقاومت برای نمایش مدل مداری است. امپدانس، مفهوم مقاومت در مدارهای AC را توسعه می دهد و برخلاف مقاومت که فقط دارای اندازه است، دارای اندازه و فاز می باشد.
همچنین، اعمال ولتاژ V با زاویه فرکانسی ω ، باعث ایجاد اختلاف فاز ∅ با I میشود. بنابراین، روابط ولتاژ و جریان در مدار AC توسط معادله شکل 4 بیان میشود.
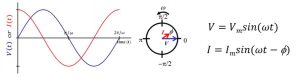
در این معادلات، V_m و I_m به ترتیب مقادیر ماکزیمم V و I را نشان میدهند. (Z(ω که از تقسیم V و I به دست میآید، شامل دو قسمت حقیقی و موهومی است که قسمت حقیقی بیانگر مقاومت مدار و قسمت موهومی نشاندهندهی ترکیبی از خازن و سلف مدار است.
معرفی نمودارهای Bode و Nyquist
نمودار بُد یکی از پرکاربردترین نمودارها در انواع رشتهها است. در این نمودار محور عمودی “لوگاریتم اندازهی امپدانس” و یا “فاز امپدانس” بوده و محور افقی نیز لوگاریتم فرکانس را نشان میدهد. مزایای نمودار بُد مشاهده لبه فاز است، که در آن سیستم ناپایدار میشود. بنابراین، برای مطالعه سنسورها، فیلترها، ترانزیستورها در قطعات الکترونیکی بسیار مفید است.
نمودار قسمت موهومی امپدانس نسبت به قسمت حقیقی آن، که در فرکانسهای مختلف اندازه گیری شده باشند، در منابع مختلف به نام نمودار نایکوئیست Nyqueist شناخته میشود. این نمودار برای تشخیص پایداری سیستمهای دارای فیدبک مناسب است. در بین این دو نوع نمایش ، نمودار نایکوئیست به علت راحتی تجزیه و تحلیل مکانیسم واکنش فعال غالباً در تحلیل مشخصهیابی باتریهای لیتیوم یون استفاده شده است.
بررسی ساده ی یک مدار امپدانسی
مدل مداری برای EIS شامل عناصر مدار الکتریکی مانند مقاومتها (R)، خازنها (C) و سلفها (L) است. یک مدل مدار بهینه از نظر فیزیکی باید معنی دار باشد و تعداد متغیرها را به حداقل برساند. در مورد باتری لیتیوم یون، عناصر اضافی مانند عنصر فاز ثابت (CPE) و امپدانس واربرگ (W) به ترتیب به عنوان مکمل خازن غیر ایدهآل و مدل سازی نفوذ یون لیتیوم استفاده میشوند.
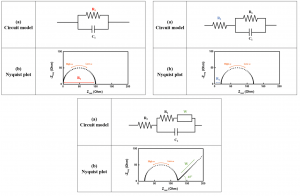
مدلهای امپدانسی باتری لیتیوم یون
کل سلول باتری لیتیوم یون با استفاده از مدل معادل در شکل 7 مدلسازی شده است. از آنجائیکه این مدل مداری متغیرهای زیادی دارد، لازم است این عناصر مداری را برای آنالیز امپدانس کاربردی به حداقل رساند.
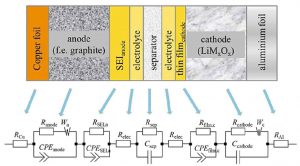
در میان این عناصر مدار، اثر خازنی جداکننده Csep در مقایسه با دیگر اجزاء حداقل است. بنابراین از آن چشمپوشی میکنیم. همچنین، میتوان مقاومتهای جداکننده، الکترولیت و جمع کننده جریان را با مقاومت بدنه ترکیب کرد. مدلهای خازنی در مدلسازی باتری لیتیوم یون خازتهای ایده آل نیستند. بنابراین برای یک مدل دقیق تر از یک عنصر فاز ثابت (CPE) استفاده میکنیم.
مدار معادل ساده شده کل در یک نیم سل باتری لیتیوم یون در شکل 8 نشان داده شده است.
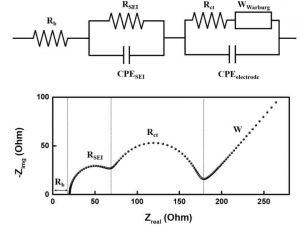
عناصر مدار
در شکل بالا، عناصر به صورت زیر تعریف میشوند:
R_b: مقاومت بدنه (مقاومت بالک)، الکترولیت، جداکننده و الکترود (الکترولیت، جداکننده و الکترودها)
R_SEIو CPE_SEI: مقاومت و ظرفیت خازن لایه فصل مشترک SEI
R_ct: مقاومت انتقال بار
CPE_electrode : ظرفیت خازن لایه دوگانه که بین الکترود و الکترولیت تشکیل میشود
W: اثر پخش و نفوذ یون لیتیوم در مواد
R_b (مقاومت بالک)
مقدار مقاومت داخلی باتری (به صورت سری) مانند جمع کننده جریان، الکترولیت و جدا کننده را نشان میدهد. این مقاومت با تغییر بار، تغییرات چندانی نمیکند اما با تکرار چرخه ی شارژ و دشارژ ، این مقاومت به علت ورود و خروج یون لیتیوم و تشکیل میکروترکها در مواد فعال، افزایش مییابد. بنابراین مقاومت بالک به عنوان یک شاخص در تعیین حالت سلامتی در باتریها استفاده میشود.
R_SEI
مقدار مقاومت لایهی SEI را نشان میدهد که از طریق تجزیه الکترولیت در باتری روی سطح آند تشکیل میشود. و دارای تأثیر عمیقی بر روی مشخصهیابی الکتروشیمیایی مواد آندی نسبت به مواد کاتدی است.
مقاومت لایه SEI بستگی به مواد تشکیل دهنده الکترولیتهای متنوع مانند حلالها (EC، EMC و MB) و نمکهای لیتیومی مانند ( LiBF4،LiSO3CF3، LiBOB و LiPF6 ) دارد. R_SEI به واکنش الکترولیت در طی اولین چرخه لیتیوم لیتیومدار شدن بسیار حساس است. با این حال لایه SEI با محدود کردن انتقال یون لیتیوم و ایجاد مقاومت در سراسر الکترود، باعث محدود شدن جریان، ظرفیت و پاسخ دینامیکی باتریهای لیتیوم- یون میگردد. به منظور عملکرد مطلوب باتری لیتیوم- یونی، لایه SEI بایستی نسبت به یونهای لیتیوم بسیار نفوذپذیر باشد. و همچنین لایه SEI باید یک لایه ی نازک باشد و از ضخیم شدن آن جلوگیری شود و منجر به ایجاد مقاومت داخلی بالا، دشارژ خودبهخودی و کاهش بازده باتری لیتیوم- یون نگردد.
Rct
به مقاومت انتقال بار در واکنش الکتروشیمیایی ارتباط داده شده است و با پوشش دهی سطح، انتقال فاز، مقدار شکاف انرژی و اندازه ذرات تغییر میکند. این مقاومت به شدت وابسته به ولتاژ و دما بوده و مقدار آن متناسب با مساحت سطح فعال انتقال بار است. تغییرات Rct وابسته به حالت شارژ/ دشارژ است. مقدار Rct نه تنها در فهمیدن مکانیسم واکنش در باتری لیتیوم یون بلکه در تحقیق برای بهینه سازی عملکرد چرخهی شارژ و دشارژ باتریهای تجاری کمک میکند.
w
امپدانس واربرگ (W) مرتبط با فرآیند پخش و نفوذ یون لیتیوم در مواد الکترودی است، که بطور مستقیم در بسامد پایین مدل سازی میشود.
تحلیل نمودارهای EIS
مقدار اولیهی محل تقاطع محور x از نمودار نایکوئیست بعنوان R_b معرفی میشود. این مقدار بطور قابل توجهی به حالت سلامتی سیستم مرتبط است. تشکیل میکروترکها، تحول گازی، تجزیه پیوند، خوردگی جمع کنندههای جریان و تخلیه الکترولیت همه بعنوان دلیل پیری باتری و تخریب عملکرد گزارش شده اند و میتوانند مقدار R_b را افزایش دهند.
اولین نیمدایره
در نمودار نایکوئیست شکل 8، در ارتباط با تولید لایه SEI است. این مقدار در تجزیه و تحلیل تشکیل لایه SEI که نتیجه اش تجزیه الکترولیت است، مورد استفاده قرار میگیرد. نتایج آزمون ولتامتری چرخهای نشان میدهد که بخش اعظم لایه SEI در چرخه اول تشکیل میگردد و با ادامه چرخههای ولتامتری لایه SEI به پایداری میرسد .
دومین نیمدایره
در نمودار نیکوئیست شکل 8، R_ct وابسته به واکنشهای الکتروشیمیایی است . توسط پوشش سطح، انتقال فاز، مقدار گاف انرژی یا اندازه ذرات تغییر میکند. این مقدار مقاومت انتقال بار فارادیک، وابستگی دمایی یا مکانیسم واکنشهای مشخصهیابی در باتری لیتیوم یون را نشان میدهد.
خط مستقیم نهایی
سرانجام، امپدانس واربرگ، خط مستقیم نهایی در نمودار نیکوئیست است که وابسته به پخش یونهای لیتیوم است و در فرکانسهای پایین به دست میآید.
تغییرات امپداس
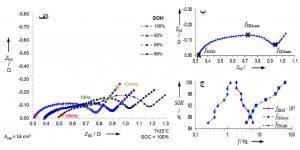
در شکل 9-الف در طی گذشت زمان برای باتری، طیف امپدانس به تدریج به مقادیر بالاتر Zrealحرکت کرده و شکل نیمدایره نیز تغییر کرده است.. در شکل 9-ب نقطه شروع در طیف امپدانس f_(ZIM,0) ، نشاندهنده یک مقاومت کاملاً اهمی است. ماکزیمم نیمدایره در طیف امپدانس مربوط به فرآیند انتقال بار و بصورت f_(ZIM,MAX) بیان میشود و پخش لیتیوم با بسامد f_(ZIM,MIN) شروع میشود. تغییرات این سه مقدار در نمودار “ج” متناسب با سطح سلامت سلول(SOH) نشان داده شده است . f_(ZIM,MIN) در شکل 9-ج به سمت مقادیر فرکانسی پایینتر حرکت کرده است که علت آن کاهش سلامتی از 100% به 86% است. f_(ZIM,0) به سمت مقادیر بالاتر فرکانس تغییر یافته که افزایش در مقاومت داخلی را نشان میدهد.
نتیجه گیری
در این مقاله سعی شد تا اصول کلی اندازهگیری EIS توضیح داده شود و المانهای مداری برای توصیف داخل باتری لیتیوم یون نیز معرفی گردید و همچنین با بیان نکات کاربردی و شناخت عوامل تاثیرگذار، عملکرد باتری لیتیوم یون، را توضیح دهیم. روش EIS در تحقیقات باتریهای لیتیوم یون بسیار کمک میکند و برای محققان حوزهی باتری بسیار اهمیت دارد. برای تحلیل نمودارهای نایکوئیست کافیست که ما با تغییر فرکانس از 0 تا بینهایت، مدار را تحلیل کرده و عناصر آن را استخراج کنیم.
منبع:Modeling and Applications of Electrochemical Impedance Spectroscopy (EIS) for Lithium-ion Batteries





بسیار مفید بود. سپاسگزارم
سلام.ممنون از اظهار لطفتان
با تشکر فراوان از اظهار نظر و لطف شما
با سلام و تشکر از تدوین مطالب جامع شما
من از مطالبی که نوشته اید برای تکمیل سمینارم در مورد امپدانس الکتروشیمیایی و نمودارها استفاده کرده ام.. برای اینکه مدیون شما خوبان نشم لطف میکنید بگید که چگونه از سایت شما به عنوان منبع نام ببرم.
آیا نوشتم ( سایت رها باتری) کافیست؟
سلام خدمت شما. در مورد منبع زدن برای سمینار و پایان نامه اطلاعی ندارم اما از نظر شرکت، ذکر نام رهاباتری کافیست.
با تشکر از شما بابت رعایت حق انتشار
سلام رابطه ریاضی مقاومت داخلی باتری لیتیوم یون 18650 بر حسب زمان در طول چند سیکل به چه صورت است؟
سلام خدمت شما. این سوال جواب دقیقی ندارد چرا که مقاومت داخلی باتری (Rs) به پارامترهای گوناگون بستگی دارد و نمی توان به صورت مستقل آن را بررسی نمود.
به صورت کلی میتوان گفت با افزایش سیکل، مقاومت درونی باتری افزایش میابد اما این که بتوان آن را بر حسب زمان یا تعداد سیکل مدل کرد، من تا به الان ندیدم.
دما، جریان شارژ، جریان دشارژ، نحوه ی شارژ و نحوه ی دشارژ از پارامترهای تاثیرگذار بر مقاومت درونی هستند و تغییر مقاومت درونی به دلیل تغییر در ساختار داخلی باتری رخ می دهد. اگر شرایط ایده آل باشد، باید انتظار داشت که مقاومت درونی باتری تغییر نکند. اما در عمل این اتفاق نمی افتد و مقاومت درونی باتری به شدت به عوامل محیطی وابسته می باشد.
با سپاس فراوان
بسیار عالی بود.
ممنون از اظهار لطفتون